Главная | О нас | Доставка | Рекламодателям | Войти | Регистрация
Доставка в воскресенье и праздничные дни не работает!
- Лекарства
- БАДыВитамины
- Категории от А до Я
- Бренды от А до Я
- Продукты от А до Я
- Медтехника
- Красота
- Ребенок
- Уход
- Изделия мед. назначения
- Травы и фито-чаи
- Лечебное питание
- Путешествие
- Изготовление лекарствАкции
Аптека онлайн, это лучшая аптека алматы, доставляющая лекарства в алматы. Интернет аптека или онлайн аптека оказывает следующие виды услуг: доставка лекарств, лекарства на дом. Интернет аптека алматы или аптека алматы онлайн осуществляет доставка лекарств на дом, а так же доставка лекарств на дом алматы.
Моя корзина
Apteka84.kz — интернет-аптека, предлагает своим клиентам лекарственные средства, лечебную и декоративную косметику, биологически активные пищевые добавки, витамины, детское питание, интим товары для взрослых, медицинскую технику и тысячи других медицинских и косметических изделий по низким ценам. Все данные, представленные на сайте Apteka84.kz, имеют исключительно информационный характер и не являются заменой профессиональной медицинской помощи. Apteka84.kz настоятельно рекомендует внимательно читать инструкцию по применению, находящуюся в каждой упаковке лекарственных и других средств. Если в настоящий момент у вас имеются те или иные симптомы заболевания, вам следует обратиться за помощью к врачу. Вы обязательно должны сообщать врачу или фармацевту обо всех лекарственных средствах, которые вы принимаете. Если вы чувствуете, что вам требуется дополнительная помощь, пожалуйста, проконсультируйтесь с Вашим местным фармацевтом или свяжитесь с нашим терапевтом в режиме он-лайн или по телефону.
© 2022 Аптека 84.
Висмута трикалия дицитрат 120мг 56 шт. таблетки покрытые пленочной оболочкой
Фармакологическое действие
Препарат, оказывающий защитное действие на слизистую оболочку желудка и двенадцатиперстной кишки. Противоязвенный препарат.
Состав и форма выпуска Висмута трикалия дицитрат 120мг 56 шт. таблетки покрытые пленочной оболочкой
Таблетки — 1 таб.:
- Активные вещества: висмута трикалия дицитрата — 304.6 мг, что соответствует содержанию висмута оксида — 120 мг;
- Вспомогательные вещества: крахмал кукурузный — 71.1 мг, полиакрилат калия — 23.6 мг, повидон К25 — 17.7 мг, макрогол 6000 — 6 мг, магния стеарат — 2 мг;
- Состав пленочной оболочки: гипромеллоза — 5.5 мг; титана диоксид — 3 мг; макрогол-4000 — 1.5 мг.
7, 8, 10, 14, 28, 30, 50, 56, 60, 100, 112, 160 или 240 шт. — упаковки ячейковые картонные или банки из полиэтилентерефталата (1, 2, 3, 4, 5, 6, 7, 8, 10, 16) — пачки картонные.
Описание лекарственной формы
Таблетки, покрытые пленочной оболочкой белого или почти белого цвета, круглые, двояковыпуклые, без запаха или со слабым характерным запахом, на поперечном разрезе видны два слоя: ядро белого или белого с желтоватым оттенком цвета и пленочная оболочка.
Способ применения и дозы
Взрослым и детям старше 4 лет — внутрь 2-4 раза/сут за 30 мин до приема пищи. Доза зависит от возраста пациента.
Курс лечения — 4-8 недель. В течение следующих 8 недель не следует принимать препараты, содержащие висмут.
Для эрадикации Helicobacter pylori целесообразно применение висмута трикалия дицитрата в комбинации с антибактериальными препаратами, обладающими антихеликобактерной активностью.
Фармакодинамика
Противоязвенное средство с бактерицидной активностью в отношении Helicobacter pylori. Обладает также противовоспалительным и вяжущим действием. В кислой среде желудка образует нерастворимые висмута оксихлорид и цитрат, а также образуются хелатные соединения с белковым субстратом в виде защитной пленки на поверхности язв и эрозий. Увеличивая синтез простагландина Е, образование слизи и секрецию гидрокарбоната, стимулирует активность цитопротекторных механизмов, повышает устойчивость слизистой оболочки ЖКТ к воздействию пепсина, хлороводородной (соляной) кислоты, ферментов и солей желчных кислот. Приводит к накоплению эпидермального фактора роста в зоне дефекта. Снижает активность пепсина и пепсиногена.
Фармакокинетика
Висмута трикалия дицитрат практически не всасывается из ЖКТ. Однако незначительное количество висмута может поступать в системный кровоток. Выводится преимущественно с калом. Незначительное количество висмута, поступившее в плазму, выводится почками.
Показания к применению Висмута трикалия дицитрат 120мг 56 шт. таблетки покрытые пленочной оболочкой
Язвенная болезнь желудка и двенадцатиперстной кишки в фазе обострения (в т.ч. ассоциированная с Helicobacter pylori); хронический гастрит и гастродуоденит в фазе обострения (в т.ч. ассоциированный с Helicobacter pylori); синдром раздраженного кишечника, протекающий преимущественно с симптомами диареи; функциональная диспепсия, не связанная с органическими заболеваниями ЖКТ.
Противопоказания
Выраженное нарушение функции почек, беременность, период лактации, повышенная чувствительность к висмута трикалия дицитрату.
Применение Висмута трикалия дицитрат 120мг 56 шт. таблетки покрытые пленочной оболочкой при беременности и кормлении грудью
Противопоказано применение при беременности и в период лактации (грудного вскармливания).
Применяется у детей старше 4 лет согласно режиму дозирования.
Особые указания
Не следует применять более 8 недель.
Во время лечения не рекомендуется превышать установленные суточные дозы для взрослых и детей.
По окончании курсового лечения в рекомендуемых дозах концентрация активного вещества в плазме крови не превышает 3-58 мкг/л, а интоксикация наблюдается лишь при концентрации более 100 мкг/л.
На фоне применения возможно окрашивание кала в черный цвет вследствие образования сульфида висмута. Иногда отмечается незначительное потемнение языка.
Побочные действия Висмута трикалия дицитрат 120мг 56 шт. таблетки покрытые пленочной оболочкой
Со стороны пищеварительной системы: возможны транзиторные эффекты — тошнота, рвота, учащение стула, запор.
Дерматологические реакции: кожная сыпь, зуд.
Со стороны ЦНС: при длительном применении в высоких дозах — энцефалопатия, связанная с накоплением висмута в ЦНС.
Лекарственное взаимодействие
При одновременном приеме других лекарственных средств, а также пищи и жидкости, в частности, антацидов, молока, фруктов и фруктовых соков возможно изменение эффективности висмута трикалия дицитрата.
Кларитромицин
Кларитромицин, 14‑членный макролид, представляет собой производное эритромицина с аналогичным спектром активности и показаниями к применению. Однако в отличие от эритромицина он более устойчив к воздействию кислот и имеет более длительный период полувыведения. Результаты исследований, доказывающих, что схема тройной эрадикационной терапии хеликобактер пилори с использованием кларитромицина дает положительный результат в 90 % случаев, привели к широкому использованию антибиотика.
В связи с этим в последние годы было зафиксировано увеличение распространенности устойчивых к кларитромицину штаммов H. pylori. Нет никаких доказательств того, что увеличение дозы кларитромицина позволит преодолеть проблему антибиотикорезистентности к препарату.
Одной из значимых проблем гастроэнтерологии является желчекаменная болезнь (ЖКБ). Это обусловлено широкой распространенностью заболевания, неуклонным ростом численности больных, в т. ч. трудоспособного возраста [2]. Несмотря на существование консервативных методов, основным методом лечения ЖКБ остается холецистэктомия (ХЦЭ) [3, 8]. Однако удаление желчного пузыря (ЖП) не всегда избавляет больных от страданий. От 5 до 40 % пациентов в различные сроки после операции испытывают боли в верхних отделах живота и диспепсические расстройства, в развитии которых важную роль играет патология эзофагогастродуоденальной зоны (ЭГДЗ) [3, 8, 12]. По данным Ильченко А.А. (1998) и Графова А.А. (2006), заболевания пищевода, желудка, двенадцатиперстной кишки (ДПК) диагностируют у 11,3–51,9 % больных ЖКБ и у 31–84,6 % пациентов после ХЦЭ. При этом структурно-функциональные особенности ЭГДЗ у лиц без ЖП освещены в литературе недостаточно полно.
В ряде работ имеются указания на снижение секреторной функции желудка и часто развивающийся после операции дуоденогастральный рефлюкс (ДГР), обусловленный моторно-эвакуаторными нарушениями ДПК [11, 12]. Снижение кислотопродукции, по данным Сотникова В.Н. и соавт. (2005), ассоциировано с атрофическими изменениями слизистой оболочки желудка (СОЖ) и способствует возникновению кишечной метаплазии, полипов и рака желудка. В связи с этим актуальным представляется изучение не только морфологических особенностей ЭГДЗ у лиц без ЖП, но и моторно-секреторной активности гастродуоденального комплекса с помощью суточной рН-метрии. Преимущества метода заключаются в продолжительной регистрации рН, приближенной к физиологическим условиям, малой инвазивности, хорошей переносимости, возможности индивидуального подхода к терапии [9, 10, 13].
Перспективным в лечении гастродуоденальной патологии является применение цитопротекторов разных классов, например препаратов висмута. Механизм действия висмута трикалия дицитрата (ВТД) связан с осаждением нерастворимых солей висмута (оксихлорида и цитрата) и образованием хелатных соединений с белковым субстратом, создающим нерастворимое защитное покрытие в месте язвенного дефекта [7]. ВТД увеличивает образование слизи и секрецию гидрокарбоната путем ускорения синтеза простагландина E, снижает активность пепсина и пепсиногена, стимулирует активность цитопротекторных механизмов [5, 14]. Он подавляет процессы перекисного окисления липидов с одновременной защитой ДНК [15]. Принципиально важно, что указанные эффекты реализуются без вмешательства в физиологию желудка, прежде всего в регуляцию продукции соляной кислоты.
Целью проведенной работы было выявление структурно-функциональных особенностей ЭГДЗ и оценка эффективности применения ВТД у лиц с удаленным ЖП с учетом результатов суточной рН-метрии.
Материал и методы
Исследование проведено в два этапа. На первом этапе для определения частоты встречаемости признаков патологии ЭГДЗ у лиц с удаленным ЖП были анкетированы 625 человек с холецистэктомией в анамнезе. Из них 335 (53,6 %) человек находились на амбулаторном или стационарном лечении, 290 (46,4 %) не обращались к гастроэнтерологу, но добровольно согласились принять участие в анкетировании.
На втором этапе проспективно обследованы 94 пациента без ЖП, которых распределили в две группы в зависимости от сроков, прошедших после холецистэктомии: 43 пациента, перенесшие ХЦЭ от 1 до 3 лет, 51 – более 3 лет назад. Соотношение женщин и мужчин среди лиц основной группы составило 3,3 : 1,0. Средний возраст пациентов без ЖП в сроки от 1 до 3 лет после ХЦЭ составил 60,60 ± 2,55 года, в сроки более 3 лет – 60,7 ± 1,97 года. Для более полного представления о частоте встречаемости патологии ЭГДЗ у лиц без ЖП в исследование были включены как пациенты с гастроэнтерологическими жалобами (64 человека), так и без таковых (30 человек). Группу сравнения составили 62 пациента с умеренно выраженным обострением хронического калькулезного холецистита (соотношение женщин и мужчин – 3,1 : 1,0). В группе сравнения средний возраст пациентов составил 59,90 ± 1,59 года. В контрольную группу вошли 25 практически здоровых лиц.
Критерии исключения из исследования:
- проведение ХЦЭ в сроки менее года;
- “органические” причины постхолецистэктомических расстройств (стриктура холедоха, удлиненная культя пузырного протока, рецидив холедохолитиаза и др.);
- возраст старше 70 лет;
- острая хирургическая патология (острый холангит, механическая желтуха, перитонит);
- декомпенсация хронических соматических заболеваний;
- опухоли различной локализации;
- отказ от участия в исследовании.
Клинико-инструментальное обследование осуществлялось при добровольном информированном согласии пациентов. Помимо стандартного клинико-лабораторного обследования всем пациентам проводили эзофагогастродуоденоскопию (ЭГДС) с прицельной биопсией СО нижней трети пищевода, антрального отдела и тела желудка, луковицы ДПК как при наличии видимых изменений СО, так и при визуально неизмененной СО. Для гистологического исследования биоптатов была использована общепринятая методика с окраской гематоксилинэозином. Helicobacter рylori выявлена с помощью гистобактериоскопического метода и быстрого уреазного теста (тест-система “Хелпил”; Ассоциация медицины и аналитики, Санкт-Петербург).
Суточная рН-метрия была проведена 75 пациентам с помощью аппарата “Гастроскан-ЭКГ” (“Исток-система”, Фрязино). Зонды для рН-метрии установлены в нижней трети пищевода, теле и антральном отделе желудка, результаты обрабатывались с помощью компьютера. Во время проведения суточной рН-метрии пациенты находились в привычных для них условиях: не ограничивали физические нагрузки, продолжали принимать пищу в обычном режиме; вели дневник, где отмечали различные жалобы (изжогу, боли в животе и т. д.). За нормальные значения кислотности в пищеводе принимали рН 6,0–7,0, в антральном отделе желудка – 1,3–7,4, в теле желудка – 1,5–2,0. Гастроэзофагеальными рефлюксами (ГЭР) считали эпизоды, при которых рН в пищеводе опускалось ниже 4, рефлюксами желчи (дуоденогастроэзофагеальными рефлюксами – ДГЭР) – эпизоды подъема рН выше 7. Под ДГЭР понимали эпизоды повышения рН в антральном отделе желудка более 7,4. Уровень базальной секреции тела желудка в пределах рН 1,5–2,0 расценивали как нормацидность, рН менее 1,5 – гиперацидность, рН от 2,1 до 6,0 – гипоацидность, свыше 6,0 – анацидность. Результаты исследования обрабатывались статистически с применением критериев достоверности Стьюдента и Манн–Уитни.
Результаты и обсуждение
На первом этапе обследования из 625 пациентов с ХЦЭ в анамнезе 335 (53,6 %) больных, находившихся на амбулаторном или стационарном лечении, при анкетировании отмечали абдоминальные боли в эпигастрии различной степени выраженности и симптомы желудочной диспепсии, характерные для заболеваний пищеварительного тракта, в т. ч. для патологии ЭГДЗ. Среди 290 (46,4 %) пациентов, не наблюдавшихся у гастроэнтеролога, диспепсические симптомы при целенаправленном анкетировании были выявлены у 65 (10,4 %), отсутствовали у 225 (36 %). Общее число пациентов с клиническими признаками патологии ЭГДЗ составило 400 (64 %).
Анализ клинической картины показал, что существенным является не только отсутствие ЖП, но и сроки, прошедшие после операции. По результатам анкетирования, у лиц без ЖП в сроки 1–3 года после операции по сравнению с пациентами, страдавшими ЖКБ, достоверно чаще встречались абдоминальные боли постоянного характера (48,8 и 33,9 % соответственно) в эпигастрии (25,6 и 22,6 %) или опоясывающие в верхних отделах живота (44,1 и 30,6 %). Из диспепсических расстройств в ранние сроки после ХЦЭ горечь во рту (65,1 %), изжогу (58,1 %), отсутствие аппетита (11,6 %) отмечали чаще, чем при ЖКБ (54,8; 27,4 и 8,1 % соответственно). Через 3 года и более после ХЦЭ с большей частотой выявлялись постоянные боли (60,8 %) в эпигастрии (31,4 %) и боли опоясывающего характера (49 %); тошнота (43,1 %), горечь во рту (66,7 %), отрыжка (39,2 %), отсутствие аппетита (17,7 %). Полученные результаты свидетельствуют о том, что ХЦЭ, избавляя пациентов от приступов желчной колики и от самого ЖП, не приводит к полному выздоровлению и не всегда улучшает состояние органов ЭГДЗ. Некоторые диспепсические симптомы и постоянные боли в эпигастрии встречаются у лиц без ЖП чаще, чем до операции, особенно в сроки более 3 лет после ХЦЭ.
На втором этапе в исследование были включены пациенты, как имеющие, так и не имеющие гастроэнтерологических жалоб. При эндоскопическом обследовании поражение ЭГДЗ было выявлено у 95,3 % пациентов без ЖП с болевым и диспепсическим синдромами и у 81,4 % пациентов – в отсутствие клинических проявлений заболевания. Очевидно, что отсутствие клинической симптоматики не всегда означает отсутствие морфофункциональных изменений ЭГДЗ. Бессимптомное течение гастродуоденальной патологии у части больных создает иллюзию благополучия, затрудняет своевременную диагностику и лечение.
По результатам исследования катаральный эзофагит у лиц без ЖП встречался чаще (8,1 %), чем при ЖКБ; частота его обнаружения была сходной в различные сроки после холецистэктомии (9,3 и 9,8 %). Эрозий СО пищевода не было выявлено ни у одного из обследованных пациентов.
Наибольшей частотой и многообразием отличались изменения СОЖ, преимущественно антрального отдела, диагностированные у 90,7 % в ранние и 96 % в отдаленные сроки после холецистэктомии. Структурные особенности СОЖ у пациентов без ЖП в различные сроки после холецистэктомии представлены на рис. 1 и 2. В сроки от 1 до 3 лет после ХЦЭ достоверно чаще, чем при ЖКБ, обнаружкны поверхностный гастрит (20,9 %), рефлюксгастрит (13,9 %), острые эрозии СОЖ (6,9 %), ДГР (34 %), хронический дуоденит и папиллит (18,6 и 11,6 %). Через 3 года и более после холецистктомии увеличивалась частота встречаемости рефлюкс-гастрита (21,6 %), очагового и мультифокального атрофического гастрита (13,7 и 5,9 %), ДГР (35,3 %), хронического дуоденита и папиллита (21,6 и 17,6 % соответственно). Частота встречаемости эрозивно-язвенных дефектов и рубцовой деформации привратника и луковицы ДПК была сходной в основных группах и группе сравнения.
При морфологическом исследовании биоптатов СО пищевода частота встречаемости умеренно выраженной лейкоцитарной инфильтрации в разные сроки после ХЦЭ была сходной и составила 9,3 и 9,8 %. Однако в сроки более 3 лет после ХЦЭ были выявлены признаки дистрофии (5,9 %), атрофии (3,9 %) эпителия и цилиндрической метаплазии (3,9 %). Подобные изменения характерны для длительного течения эзофагита и могут быть связанными с агрессивным действием желчных кислот и пепсина в результате ДГЭР. Морфологические изменения СОЖ у пациентов в различные сроки после ХЦЭ представлены на рис. 3. У пациентов, перенесших ХЦЭ от 1 до 3 лет назад, по сравнению с пациентами, страдавшими ЖКБ, чаще выявляли: гастрит с поражением желез без атрофии (30,5 %), регенераторную гиперплазию покровного эпителия (47,3 %), дисплазию I–II степеней (4,65 %) и кишечную метаплазию СОЖ (11,6 %). С увеличением срока, прошедшего после ХЦЭ, до 3 лет и более достоверно чаще встречались атрофия желез (9,8 %), кишечная метаплазия (17,6 %) и дисплазия желудочного эпителия I–II степеней (7,8 %).
Гистологические изменения СО ДПК через 1–3 года после операции соответствовали умеренной атрофии в 25,3 % случаев, лимфоцитарной инфильтрации – в 9,1 %. Через 3 и более лет после операции субатрофический дуоденит обнаружен в 25,5 %, чаще встречалась лимфоцитарная инфильтрация (15,7 %), были выявлены признаки желудочной метаплазии (3,9 %).
Обсемененность СОЖ Н. рylori у пациентов без ЖП была достоверно ниже по сравнению с больными ЖКБ: через 1–3 года после ХЦЭ – 20,2 %, в сроки более 3 лет – 18,9 %, при ЖКБ – 35,3 %. Полученные данные соответствуют опубликованным сведениям, свидетельствующим об ингибирующем влиянии желчных кислот дуоденального рефлюктата на Н. рylori [6]. Кроме того, в связи с частичной или полной атрофией желез снижается слизеобразование, что может ограничивать “среду обитания” микроорганизма [6, 12].
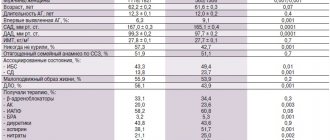
По результатам суточной рН-метрии, “кислые” и “щелочные” рефлюксы в пищеводе встречались в 2,5 раза чаще, чем эндоскопические и морфологические признаки эзофагита (табл. 1). Установлено, что с увеличением срока, прошедшего после ХЦЭ, увеличивалась частота встречаемости ДГР, ДГЭР, уменьшалась частота ГЭР. В отдаленные сроки после ХЦЭ достоверно реже регистрировалась гиперацидность, чаще – гипо- и анацидность. При этом появление острых и хронических эрозий СОЖ у лиц без ЖП в 65 % случаев происходило при нормальной или сниженной продукции соляной кислоты, а обострение язвенной болезни ДПК в 71,4 % протекало на фоне нормальной кислотопродукции. Очевидно, что у лиц без ЖП соляная кислота как фактор агрессии не имеет доминирующего значения в развитии деструктивных изменений слизистой оболочки ЭГДЗ.
. Результаты суточной рН-метрии в разные сроки после ХЦЭ.
При статиcтической обработке данных была выявлена корреляция между снижением кислотопродукции и поверхностным гастритом через 1–3 года после операции (r = 0,321), в более поздние сроки – с выраженностью атрофических изменений СОЖ (r = 0,727), наличием кишечной метаплазии (r = 0,713).
Таким образом, в отсутствие ЖП с увеличением срока, прошедшего после операции, отмечается прогрессирование моторной и секреторной дисфункции, усугубляются атрофические и дисрегенераторные изменения слизистой оболочки ЭГДЗ.
Ведущими в этиопатогенезе гастродуоденальной патологии традиционно считают хеликобактериоз и нарушение соотношения между факторами агрессии и защиты. Не вызывает сомнений доминирующая роль соляной кислоты в повреждении СО ЭГДЗ. В связи с этим основными препаратами в лечении заболеваний ЭГДЗ являются ингибиторы протонной помпы и антибиотики.
Однако, судя по результатам собственного исследования, у лиц без ЖП в развитии гастродуоденальной патологии преобладают другие механизмы. В связи с выпадением концентрационной функции ЖП учащается развитие ДГР и ДГЭР, а основным фактором, повреждающим СО пищевода и желудка, становятся преждевременно деконъюгированные желчные кислоты. Кроме того, снижается обсемененность H. рylori, прогрессируют атрофические изменения СОЖ со снижением кислотопродукции.
С учетом этого в схему лечения гастродуоденальной патологии целесообразно включать препараты ВТД, обладающие цитопротекторными свойствами и не снижающие продукцию соляной кислоты [5, 7]. Препараты висмута подавляют процессы перекисного окисления липидов с одновременной защитой ДНК от повреждения. Появились исследования, свидетельствующие о способности ионов висмута стимулировать обратное развитие атрофии эпителия желудка благодаря пролиферативному эффекту [14, 15].
В нашем исследовании при определении показаний к дифференцированному назначению препаратов использовался подход, основанный на результатах суточной рН-метрии, эндоскопического и морфологического исследований. При снижении кислотопродукции (14 больных) пациентам назначали ВТД в дозе 480 мг/ сут. Группу сравнения составили 14 пациентов, получавших омепразол в дозе 40 мг/сут. Курс приема препаратов составил 8 недель.
Результаты динамического наблюдения доказали клиническую эффективность ВТД у данной когорты пациентов. Критерием эффективности терапии явилась положительная динамика нижеуказанных параметров (табл. 2).
. Клинические признаки патологии гастродуоденальной зоны у пациентов без ЖП на фоне терапии ВТД.
Через 10–14 дней лечения пациенты, принимавшие ВТД, реже отмечали постоянные боли в эпигастрии, отрыжку, изжогу, улучшался аппетит. Известно, что этот препарат обладает цитопротекторным и антихеликобактерным действиями [7], что, возможно, и объясняет подобный регресс клинической симптоматики.
Через 8 недель после лечения пациентам была проведена фиброгастродуоденоскопия с прицельной биопсией СО пищевода, желудка и ДПК. Динамика эндоскопической и морфологической картины патологии ЭГДЗ представлена в табл. 3 и 4.
На фоне приема ВТД значительно уменьшались частота встречаемости эрозивно-язвенных дефектов СО, поверхностного гастрита, обсемененность Н. рylori и степень лейкоцитарной инфильтрации СОЖ. Известно, что соли висмута способны образовывать защитное покрытие в месте язвенного дефекта, увеличивать образование слизи и секрецию гидрокарбонатов, снижать активность пепсина, ухудшать адгезию Н. pylori, разрушать бактериальную стенку и ингибировать ферменты Н. pylori [5, 7]. Атрофические изменения, явления метаплазии и дисплазии обратному развитию не подвергались, однако и не прогрессировали.
Таким образом, патогенетическая направленность действия и доказанная эффективность ВТД обосновывают необходимость его применения при патологии ЭГДЗ в условиях отсутствия ЖП.
Выводы
С увеличением срока, прошедшего после удаления ЖП, у больных достоверно увеличивается частота встречаемости ДГР и ДГЭР, снижается секреторная активность СОЖ, нарастает атрофия СО гастродуоденальной зоны, кишечная метаплазия и дисплазия желудочного эпителия I–II степеней.
У части пациентов без ЖП патология ЭГДЗ имеет бессимптомное течение, что создает иллюзию благополучия. Однако при проведении комплексного инструментального обследования у пациентов данной группы выявляются структурно-функциональные изменения пищевода, желудка и ДПК, требующие медикаментозной коррекции.
Пациенты, перенесшие ХЦЭ, должны находиться в группе диспансерного наблюдения и направленного терапевтического воздействия. В план обследования пациентов без ЖП необходимо включать ЭГДС с прицельной биопсией, а также суточную рН-метрию. Использование суточной рН-метрии у больных данной группы позволяет эффективно диагностировать рефлюксную патологию ЭГДЗ и секреторную активность желудка, а также осуществлять индивидуальный подбор лекарственных препаратов.
При выявлении снижения кислотопродукции, при наличии эрозивно-язвенных дефектов и/или выявлении Н. рylori препаратом выбора может служить ВТД. Терапия, проводимая ВТД, способствует уменьшению абдоминальных болей, диспепсического синдрома, снижению активности воспалительного процесса.
Информация об авторах: Граушкина Елена Вячеславовна – кандидат медицинских наук, ассистент кафедры терапии педиатрического и стоматологического факультетов Саратовского ГМУ им. В.И. Разумовского; Козлова Ирина Вадимовна – доктор медицинских наук, профессор, заведующая кафедрой терапии педиатрического и стоматологического факультетов Саратовского ГМУ им. В.И. Разумовского. E-mail:[email protected]; Волков Станислав Владимирович – кандидат медицинских наук ассистент кафедры терапии педиатрического и стоматологического факультетов Саратовского ГМУ им. В.И. Разумовского, заведующий гастроэнтерологическим отделением ГКБ № 5 Саратова
Ингибиторы протонной помпы (ИПП)
Терапия ИПП доказала эффективность в различных клинических исследованиях. Хотя in vitro ИПП и оказывают прямой антибактериальный эффект на H. pylori, тем не менее они не играют важной роли в эрадикации инфекции.
Механизм синергии ИПП при сочетании с противомикробными препаратами, который повышает клиническую эффективность эрадикационной терапии, полностью не установлен. Предполагается, что антисекреторные препараты группы ИПП могут способствовать повышению концентрации антимикробных средств, в частности метронидазола и кларитромицина, в просвете желудка. ИПП уменьшают объем желудочного сока, вследствие чего вымывание антибиотиков с поверхности слизистой уменьшается, и концентрация, соответственно, увеличивается. Кроме того, снижение объема соляной кислоты поддерживает стабильность антимикробных препаратов.
Эрадикационная терапия
Несмотря на применение комбинированных схем лечения, у 10–20 % пациентов, инфицированных H. pylori, не удается достичь элиминации возбудителя. Наилучшей стратегией считается подбор наиболее эффективной схемы лечения, однако не следует исключать возможность использования двух и даже более последовательных схем в случае недостаточной эффективности терапии выбора.
В случае неудачной первой попытки эрадикации H. pylori рекомендуют сразу перейти к терапии второй линии. Посев на чувствительность к антибиотикам и переход на схемы терапии спасения показан только тем пациентам, у которых терапия второй линии также не приведет к эрадикации возбудителя.
Одной из самых эффективных «схем спасения» является комбинация ИПП, рифабутина и амоксициллина (или левофлоксацина по 500 мг) на протяжении 7 дней. Исследование итальянских ученых, проведенное под руководством Фабрицио Перри (Fabrizio Perri) и опубликованное в Alimentary Pharmacology & Therapeutics в 2000 году, подтвердило, что схема с рифабутином эффективна против штаммов H. pylori, резистентных к кларитромицину или метронидазолу. Однако высокая цена рифабутина ограничивает его широкое применение.
NB! Во избежание формирования резистентности одновременно к метронидазолу и кларитромицину эти препараты никогда не комбинируют в одной схеме. Эффективность подобной комбинации очень высока, однако у пациентов, не ответивших на терапию, обычно формируется устойчивость сразу к обоим препаратам (исследование немецких ученых под руководством Ульриха Пейтца (Ulrich Peitz), опубликованное в Alimentary Pharmacology & Therapeutics в 2002 году). И дальнейший подбор терапии вызывает серьезные затруднения.
Данные исследований подтверждают, что 10‑дневная схема терапии спасения, включающей рабепразол, амоксициллин и левофлоксацин, гораздо эффективнее, чем стандартная эрадикационная терапия второй линии (исследование итальянских ученых под руководством Энрико Ниста (Enrico C Nista), опубликованное в Alimentary Pharmacology & Therapeutics в 2003 году).
Показания к эрадикационной терапии
В соответствии с принципами, утвержденными в Маастрихте в 2000 году (the Maastricht 2–2000 Consensus Report), эрадикация H. pylori настоятельно рекомендуется:
- всем больным с язвенной болезнью;
- пациентам с низкодифференцированной MALT-лимфомой;
- лицам с атрофическим гастритом;
- после резекции по поводу рака желудка;
- родственникам больных раком желудка первой степени родства.
Необходимость проведения эрадикационной терапии пациентам с функциональной диспепсией, ГЭРБ, а также лицам, длительно принимающим нестероидные противовоспалительные препараты, пока остается предметом дискуссий. Доказательств того, что эрадикация H. pylori у подобных больных влияет на течение заболевания, нет. Однако хорошо известно, что у лиц с H. pylori, страдающих неязвенной диспепсией и корпус-преобладающим гастритом, повышается риск развития аденокарциномы желудка. Таким образом, эрадикацию H. pylori следует рекомендовать также и пациентам с неязвенной диспепсией, особенно если в гистологии выявляется корпус-преобладающий гастрит.
Аргумент против антихеликобактерной терапии у пациентов, принимающих НПВП, таков: организм защищает слизистую оболочку желудка от повреждающего действия лекарственных препаратов, повышая активность циклооксигеназы и синтез простагландина, а ИПП снижают естественную защиту. Тем не менее ликвидация H. pylori до назначения НПВП достоверно снижает риск язвенной болезни на фоне последующего лечения (исследование американских ученых под руководством Франсиса Чана (Francis K. Chan), опубликованное в The Lancet в 1997 году).
Метронидазол
H. pylori, как правило, очень чувствительны к метронидазолу, эффективность которого не зависит от pH среды. После перорального или инфузионного применения в желудочном соке достигаются высокие концентрации препарата, что позволяет достичь максимального терапевтического эффекта. Метронидазол — это пролекарство, которое в процессе метаболизма проходит активацию бактериальной нитроредуктазой. Метронидазол приводит к потере спиральной структуры ДНК H. pylori, в результате чего происходит поломка в ДНК и бактерия погибает.
NB! Результат лечения считается положительным, если результаты теста на H. pylori, проведенного не ранее 4 недель после курса лечения, будут отрицательными. Проведение теста до истечения 4 недель после эрадикационной терапии значительно повышает риск ложноотрицательных результатов. Предпочтительна отмена приема ИПП за две недели до диагностики.
Эрадикационная терапия хеликобактер пилори: схема